欧盟体外诊断医疗器械新法规(IVDR)于2017年5月25日正式发布并生效,并于2022年5月26日起开始实施,自实施日起,欧盟IVDR将取代原来的欧盟体外诊断设备指令IVDD。
问新法规IVDR开始实施会带来什么变化呢?
1、产品风险等级分类变化:新的IVDR法规产品风险等级将IVD产品分为四大类,风险从低至高排列:ClassA,ClassB,ClassC,ClassD.
2、产品注册要求变化:新分类中ClassB,C,D都需要欧盟公告机构(Notify Body)发证后产品才能进入欧盟市场。
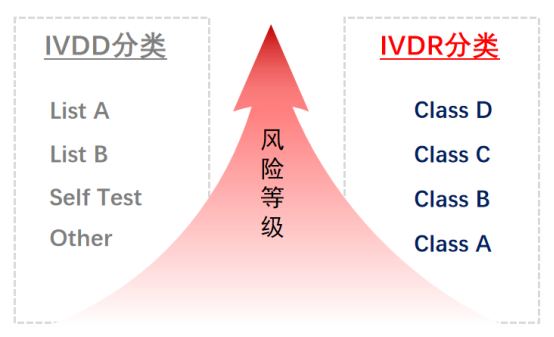
这将意味着原来IVDD监管体系下需要NB机构发证的IVD产品从原来占据市场份额的20%剧增至80%以上。即绝大部分产品将要从原先“自我声明”形式变成需要一个实质性的注册过程(NB机构参与发证)。
问依据IVDD指令获得欧盟市场准入的产品该何去何从?
2021年10月14日,因公告机构负荷不足,贸然执行IVDR会引发大面积的体外诊断产品断供,因此欧盟发布了IVDR延期提案。该提案修正了(EU)2017/746法规第110条(过渡性条款)对IVDD到IVD过渡期的规定,具体的过渡期如下:
【注】虽然过渡期法案发布后,IVD产品有了3~5年的过渡缓冲期,到目前为止欧盟官网发布的具备IVDR发证资质的公告机构(NB)仅仅7家,考虑到IVDR较长的认证周期、稀缺的公告机构资源,制造商必须结合自身产品的情况至少提前两年以上进行申请和排队,这么一来,许多产品实际上时间并不充裕,现在就需要布局认证计划啦,中检华通威将协助您的产品顺利过渡并获得CE认证!
中 检 华 通 威 服 务
01\产品检验/检测
安全、EMC、理化性能检测、生物相容性检测、产品有效期验证、生物安全评价、清洗消毒验证、内毒素、临床前功能评价、SRRC、无线共存等
02\国内注册/全球市场准入
中国NMPA(CFDA)
美国FDA
欧盟CE
巴西ANVISA (INMETRO,ANATEL )
澳大利亚TGA
加拿大CMDCAS
英国UKCA
03\咨询服务
前期产品研发法规辅导
产品技术要求评审服务
临床评价
辅厂建设
质量管理体系建设
转载注明:https://www.szhtw.com.cn/






